
为提高员工生物医学人文素养,提升员工专业技能知识,源品生物举办系列专业公开课。12月27日,研发总监郑春兵博士主讲的“干细胞技术转化与药物研发路径”主题培训课程,助力员工了解干细胞及药物研发相关专业知识,获得现场一致好评。


目前在我国,干细胞按药品、技术管理的“类双轨制”监管。按照药品监管的称为干细胞临床试验,主要由国家药品监督管理局(NMPA)监管,转化应用路径是作为药物上市销售;按照医疗技术监管的,称为干细胞临床研究,主要由卫健委监管。因此,谈及我国干细胞治疗的临床进展,可以从干细胞临床研究备案项目和干细胞新药临床试验两个角度出发。2021年10月由广东医科大学附属医院张培华教授及其团队联合源品生物申报的“应用人脐带间充质干细胞治疗糖尿病足部难愈创面的有效性与安全性的随机、开放、平行对照临床研究”项目,顺利通过项目备案,允许开展临床研究。
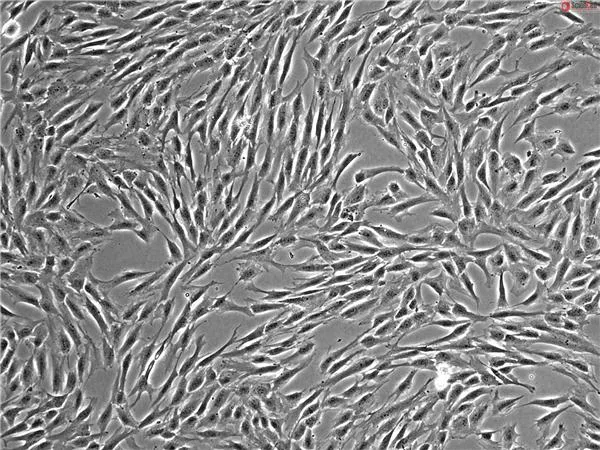
干细胞药物研发和技术转化,均离不开强大的科学技术支撑和法规的指导。2020年3月31日,科技部发布了《科技部关于发布国家重点研发计划“干细胞及转化研究”等重点专项2020年度项目申报指南的通知》,2020年7月,国家药品审评中心发布《免疫细胞治疗产品临床试验技术指导原则(征求意见稿)》,为免疫细胞药物的研发提供了更加具体的指导意见。2020年8月,国家药品审评中心发布了《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(征求意见稿)》,为药品研发注册申请人及开展药物临床试验的研究者提供更具针对性的建议和指南。
干细胞疗法是当今医学研究最前沿也是最热门的方向之一,已取得了令人振奋的成果。目前,干细胞在人类疾病治疗中的地位和价值已经初步显现,在血液疾病、免疫性疾病、严重创伤修复疾病等领域,干细胞治疗已经成为弥补传统治疗手段的有效治疗方案。
 扫一扫咨询微信客服
扫一扫咨询微信客服